AHCC®研究データと実績③
がん
RESEARCH【特定臨床研究】肝細胞がん切除術後の再発抑制研究
術後の無再発生存率の向上及び栄養状態の早期回復
進行した肝細胞がんでは、肝切除の手術が行われます。術後はがんの再発予防や栄養状態の回復が非常に重要です。術後の補助療法としてAHCC®を摂取した場合、がんの無再発生存率が約10%向上し、術後の栄養状態が早期回復することがわかりました。このことから、肝細胞がんにおける肝切除後の安全な補助療法としてAHCC®が役に立つことが期待されています。
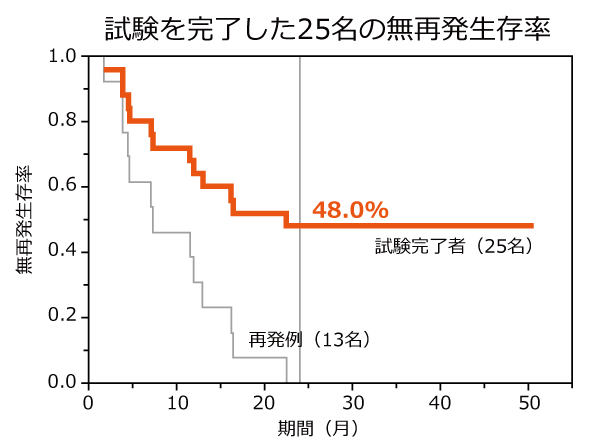
出典: Toshiya Kamiyama Integrative Cancer Therapies, 21: 15347354211073066 (2022)
方法
肝細胞がんの切除手術を受けた患者29名(試験完了者25名)を対象に、1日3.0gのAHCC®を2年間摂取して術後の状態とがんの無再発生存率について調査した。
結果
AHCC®を摂取することで、切除後2年間の無再発生存率はこれまでの治療実績に比べて約10%改善し、また術後の状態も早期に回復し、有害事象もなかった。
※今回の研究は、2018年に施行された臨床研究法に基づき、厚生労働省が認定した倫理委員会で厳しい審査が行われ、当局が管轄する臨床研究データベース(jRCT: Japan Registry of Clinical Trials)に登録・公表された特定臨床研究です。
RESEARCH肝臓がん腫瘍摘出手術後の予後*1改善研究
術後の生存率が向上し、非再発期間が延長
がんに罹ってしまったとき、手術で取り除く治療が検討されます。手術でがんを取り除いた後は予後を良好に保ち再発を防ぐことがとても重要です。 AHCC®を摂取することで肝臓がん摘出手術後の予後が良好に保たれるのかを9年間にわたって調査したところ、自由意思でAHCC®を摂取した患者さんは、がんが再発しない期間が長く、生存率も高くなったという結果が得られました。このことから、手術後の予後の改善にAHCC®が役立つことが期待されます。
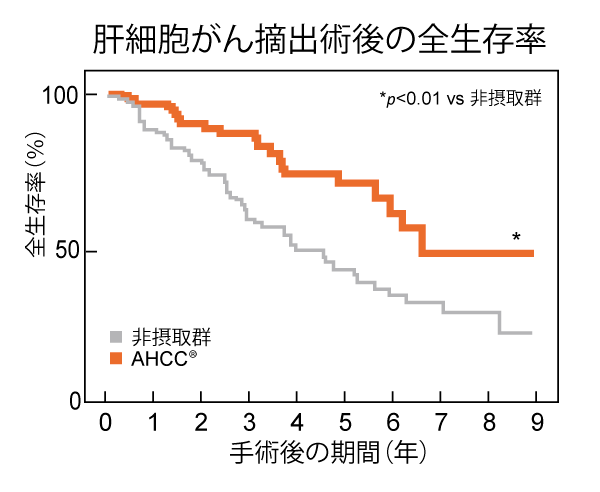
出典: Yoichi Matsui et al., Journal of Hepatology, 37(1): 78-86 (2002)
方法
肝臓がん摘出手術後の患者集団269名を、 1日3.0 gのAHCC®を自発的に摂取した113名と摂取しない156名に分け9年間追跡し、術後予後へ与えるAHCC®の作用を評価した。
結果
AHCC®を摂取することで、術後の生存率が高いという結果が示された。また、がん無再発期間も延長されることが明らかとなり、術後予後が改善することが示唆された。
*1:病気の進行具合、治療効果、生存確率を含めた病状の医学的な見通し
RESEARCH乳がん補助化学療法時の副作用軽減研究
好中球(白血球の一種)が減少する副作用を軽減
化学療法はがん治療で多く用いられる治療法です。
一方でその副作用によって薬を減らしたり中止しなければならなくなるなど、満足な治療が行えない場合も多くあります。
この研究では、AHCC®を摂取することで乳がん補助化学療法の副作用を軽減できるかを検討したところ、好中球の減少が抑えられ、好中球減少時に使う薬の使用頻度を減らせることがわかりました。
化学療法の効果を十分に発揮させるためにもAHCC®が役立つことに期待が寄せられます。
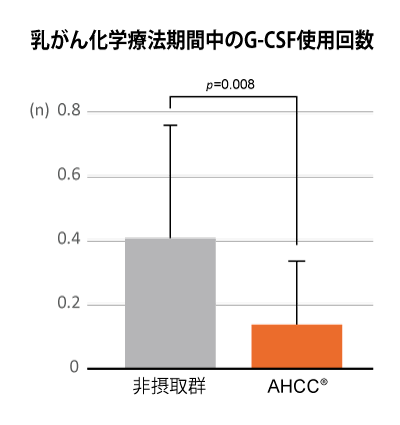
出典: Sho Hangai et al., The Journal of Alternative and Complementary Medicine, 19(11): 905-910 (2013)
方法
乳がん補助化学療法(アントラサイクリン+タキサン)を受ける患者41名を AHCC®を1日3.0 g摂取する群18名と、摂取しない群23名の2群に分けて化学療法中の有害事象の発生割合、好中球減少時に処方されるG-CSF製剤の使用頻度等を評価した。
結果
AHCC®を摂取することで、好中球減少が有意に抑えられ、G-CSFの使用頻度も有意に少なくなることが示された。以上の結果から、AHCC®が補助化学療法の副作用軽減による治療強度の維持・継続に寄与することが示唆される。
RESEARCHがん幹細胞*2の増殖抑制研究
がん幹細胞の増殖を抑制し、浸潤・転移*3を抑制する物質を増加
治療によって身体にがんが確認できない状態(寛解)になっても、再発のリスクがつきまといます。再発リスクは、患者さん本人や家族にとって見過ごせない大きなストレスのひとつです。
この研究では、がんの再発や転移の原因とされるがん幹細胞とその前駆細胞が増殖・転移するのをAHCC®が抑えられないか研究しました。
その結果、がん細胞が殖えてできる塊の数が減り、がんの転移を抑える物質も増えることが分かりました。
このことから、AHCC®の摂取により、がん幹細胞が増えるのを抑え、がんの再発や転移の予防に役立つのではと期待されています。
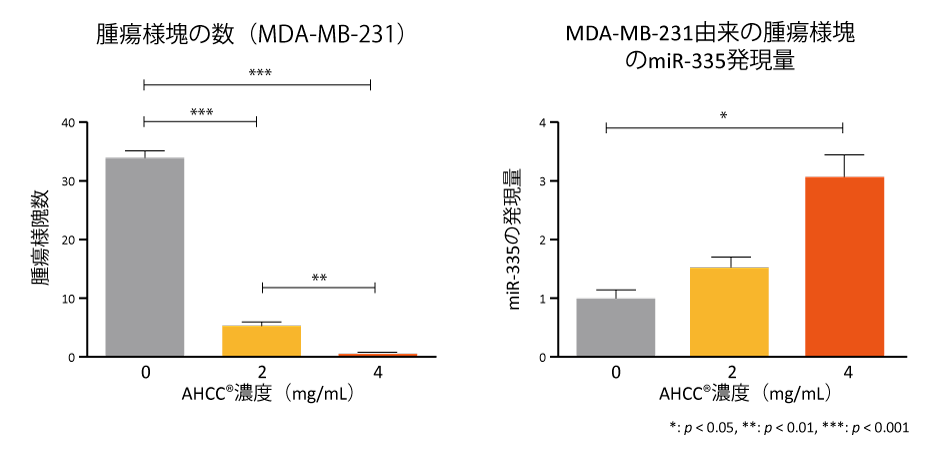
出典:Émilie A Graham et al., Cancer Biology & Therapy, 18(10): 765-774 (2017)
方法
がん幹細胞およびがん幹細胞由来腫瘍様塊にAHCC®(濃度:0, 2, 4 mg/mL)を添加・培養し、腫瘍様塊形成数や、miRNA発現等を評価した。
結果
AHCC®の添加により、腫瘍様隗数の有意な減少や、miR-335が有意に増加すること示され、がんの再発や転移の予防に寄与することが示唆された。 データは平均値±標準誤差で表示。
*2:がんの再発・転移の原因とされる抗がん剤・放射線耐性、自己の複製、腫瘍形成能を持つがん細胞
*3:周りの組織に広がり、血流などにより他の器官へと移ること
RESEARCHがん免疫療法との併用研究
免疫チェックポイント阻害剤の抗腫瘍効果を促進
免疫チェックポイント阻害剤は、がん細胞が免疫細胞に仕掛けるブレーキを外し、免疫細胞ががん細胞を攻撃することを可能にする薬です。
この研究では、AHCC®が免疫チェックポイント阻害剤の働きを高めるかどうかを検討したところ、AHCC®を併用することにより、腫瘍サイズの増加をより抑えることが分かりました。
このことから、AHCC®の摂取は免疫チェックポイント阻害剤の抗腫瘍効果を高め、治療効果の増大に役立つことが期待されます。
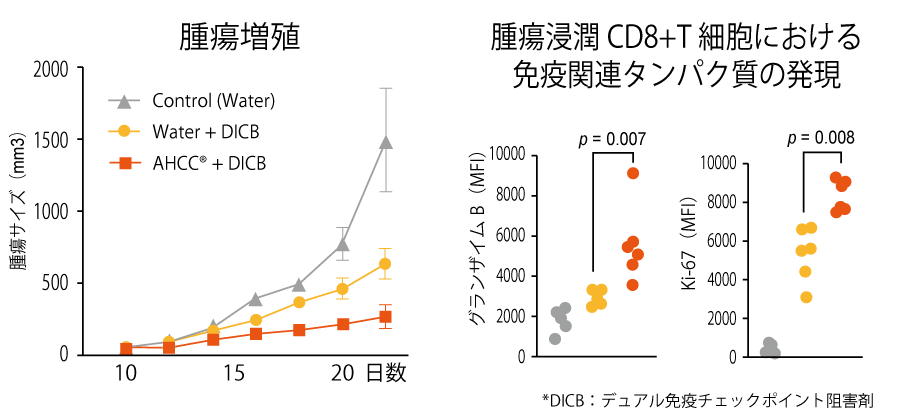
出典: Insoo Kang (Yale University, USA), et al., Frontiers in Immunology, 13: 875872 (2022)
方法
0日目にマウス大腸がん細胞MC38を皮下接種したマウスを、3日目から研究終了までAHCC®(18 mg/匹)を摂取する群(n=6)と摂取しない群(n=6)に分けた。14日目と17日目に抗マウスPD-1抗体(50 mg/匹)と抗マウスCTLA-4抗体(50 mg/匹)を投与し、腫瘍サイズ、腫瘍浸潤CD8+T細胞関連分子の発現レベル等を評価した。
結果
AHCC®と免疫チェックポイント阻害剤を併用することによりT細胞が活性化され、腫瘍浸潤CD8+T細胞による細胞傷害性分子グランザイムB及び細胞増殖マーカーKi-67の発現が増加し、腫瘍サイズの増大がより抑制されることが示された。